یکی از مهمترین پارامترها در انجام یک PCR دقیق و موفق طراحی پرایمر میباشد. امروزه برنامهها و سایتهای متنوعی در دسترس پژوهشگران قرار دارند و برای مقاصد مختلف میتوان بهترین پرایمرها را طراحی نمود و خوشبختانه اغلب آنها رایگان نیز میباشند. در زیر تعدادی از سایتهای مهم جهت طراحی پرایمر قرار داده شدهاند.
این سایت توسط NCBI ارائه شدهاست و از ترکیب پلتفرم Primer3 و BLAST برای طراحی پرایمر استفاده میکند. استفاده از BLAST غربالگری توالیهای مشابه و ناخواسته را فراهم مینماید. همچنین محل اتصال پرایمرها به توالی هدف بصورت تصویری نمایش داده میشود. طراحی پرایمر توسط این سایت انتخاب اول بسیاری از پژوهشگران است.
پرایمر 3 یک ابزار قدرتمند و جامع برای طراحی پرایمر میباشد. تعداد زیادی پارامتر قابل تغییر در این پلتفرم وجود دارد که برای طراحی پرایمرهای مناسبتر کمک کننده هستند.
این سایت نیز از پلتفرم پرایمر 3 برای طراحی پرایمر استفاده میکند. نسبت به پرایمر3 استفاده از این سایت برای کاربران آسانتر است.
این پلتفرم توسط IDT طراحی و عرضه شدهاست و برای طراحی پرایمرهای، qPCR و توالییابی بسیار مفید میباشد. توالی مورد نظر را میتوان بصورت دستی وارد و یا از NCBI ID و یا فایل اکسل آپلود کرد.
این سایت توسط ترموفیشر ارائه و طراحی شده است.
یک ابزار آنلاین برای طراحی اختصاصی پرایمر و پروب TaqMan میباشد. استفاده از آن بسیار ساده است و پارامترهای قابل تنظیم کمی دارد.
این نرم افزار بصورت رایگان قابل دانلود میباشد. طراحی پرایمرهای PCR معمولی، PCR بیسولفیت، ریل تایم PCR و توالییابی با این نرمافزار امکانپذیر میباشد. این برنامه با قابلیتهای متعددی که دارد یکی از بهترین نرمافزارهای طراحی پرایمر میباشد.
ااین نرم افزار نیز بصورت رایگان قابل دانلود میباشد. با این نرمافزار میتوان انواع مختلفی از پرایمر و پروب را طراحی و آنالیز کرد.
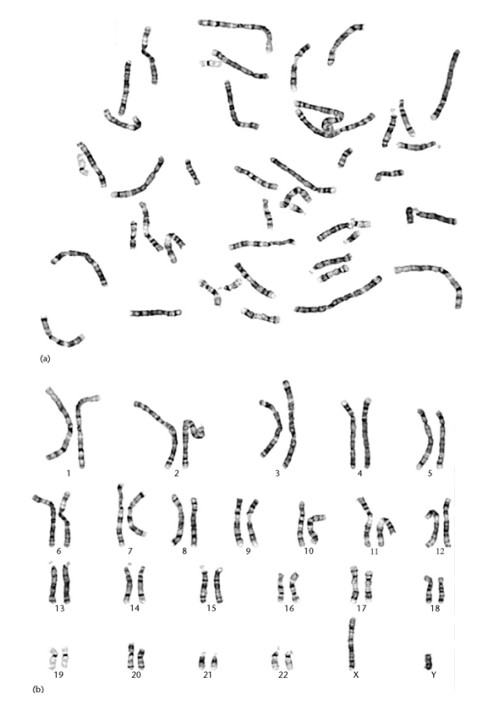
مطالعهی کروموزومها و تقسم سلولی، سیتوژنتیک نامیده میشود. هر بافت با سلولهای زنده و هستهدار قادر به تقسیم میتواند برای مطالعهی کروموزومهای انسان به کار رود. اگرچه نمونهی مناسب آنالیز کروموزومی را میتوان به سهولت از پوست، مغزاستخوان، پرزهای کوریونی یا سلولهای مایع آمنیوتیک (آمنیوسیتها) نیز به دست آورد، ولی معمولترین آنها لنفوسیتهای خون محیطی است. انتخاب بافت بسته به بیمار متفاوت است، بهعنوان مثال برای تشخیص پیش از تولد در جنین، از مایع آمنیوتیک(Amniotic Fluid) و پرزهای جفتی(Chorionic Villus) استفاده میگردد. برای بالغین و نوزادان از خون محیطی (Peripheral Blood)، و به میزان کمتری از مغز استخوان، پوست وبافتهای دیگر نیز استفاده میشود. در مواردی که ناهنجاریهای کروموزومی، اکتسابی و با Neoplasms در ارتباط باشد، از بافتی که در بدخیمی درگیر است برای بررسی میتوان استفاده کرد. تمام بافتهایی که برای تهیه کروموزوم به کار میروند در محیط کشت در آزمایشگاه، کشت داده میشوند. آزمایش کاریوتایپ برای توضیح فتومیکروگراف کروموزومهای یک فرد که به روش استاندارد مرتب شده انجام میشود. این آزمایش به بررسی تغییرات کروموزومی پرداخته و در واقع تصویری از تعداد و ساختار کروموزومهای فرد ارائه میدهد که به وسیلهی آن بسیاری از اختلالات و ناهنجاریهای کروموزومی تشخیص داده میشود. مراحل انجام آزمایش شامل کشت، هاروست، لامگیری یا تهیهی گسترهی کروموزومی، رنگ آمیزی کروموزومها و بررسی دقیق زیر میکروسکوپ میباشد.
تجهیزات و فضاهای لازم در آزمایشگاه سیتوژنتیک:
هر آزمایشگاه سیتوژنتیک، لازم است که یک محل کشت سلول جداگانه و استریل داشته باشد. بنابراین بیشتر آزمایشگاهها از هودهای با جریان Laminar استفاده میکنند. در هودهای Laminar میبایستی یک لامپ UV و جریان هوای فیلتر شده تعبیه شده باشد. این هود باید در جایی قرار گیرد که حداقل رفت و آمد و شلوغی را داشته باشند.
یک هود شیمیایی جهت تهیه و کاربا محلولها
بهتر است فضایی محفوظ جهت کنترل دما و رطوبت، در نظر گرفته شود.
دستگاه انکوباتور، فور، یخچال و فریزر، دستگاه سانتریفوژ، PH متر، دستگاه بخور گرم، میکروسکوپ نوری و اینورت، ، رطوبتسنج و دماسنج، بن ماری و سینک.
نمونه خون محیطی را به حجم کمی از محیط کشت حاوی سرم جنین گاوی(FBS) و فیتوهماگلوتینین (PHA) اضافه میکنند که لنفوسیتهای T را تحریک به تقسیم مینماید. برای کشت کروموزومی خون محیطی، باید در حد امکان از خون تازه که به آن ماده ضد انعقاد سدیم هپارین اضافه شده است، استفاده شود. کشت کروموزومی معمولا ۷۲ ساعت زمان نیاز دارد.
سلولها تحت شرایط استریل در دمای C˚٣٧ و به مدت ٣ روز کشت داده میشوند و سپس کلسمید به محیط کشت اضافه میشود. این ماده ویژگی بسیار سودمندی در جلوگیری از تشکیل دوک داشته، بهطوری که تقسیم سلولی را طی متافاز، زمانی که کروموزومها به حداکثر فشردگی خود رسیدهاند و بنابراین قابل مشاهدهاند، متوقف میکند. در ادامه نمک هیپوتونیک اضافه میشود که باعث لیز سلولها میشود. سپس با مخلوط متانول و اسیداستیک (فیکس) شستشو انجام گرفته و لامگیری صورت میگیرد. در مرحلهی بعد که Aging نامیده میشود لامها به مدت چند ساعت تا چند روز در دمای مشخصی قرار داده میشوند. اینکار جهت بالا بردن وضوح بندها است. مرحلهی بعد Banding است. یک بند به این صورت تعریف میگردد: قسمتی از کروموزوم که از طریق تیرهتر شدن یا روشنتر شدن توسط یک یا چند تکنیک بندینگ، به وضوح از قطعات مجاورش قابل افتراق میباشد. باندهایی که به وسیلهی یک روش خاصی رنگ تیره به خود میگیرند، ممکن است با دیگر روشهای رنگآمیزی رنگ روشن پیدا نمایند. در روشهای بندینگ اولیه، به منظور تولید یک الگوی باندی فلورسنت، از کیناکرین موستارد یا دیهیدروکلرید کیناکرین استفاده میگردید. این روش بر پایهی الگوی بندینگ Q میباشد. روش دیگر بندینگG-bands نام دارد، که درآن معمولا از مخلوط رنگ گیمسا به عنوان مادهی رنگآمیزی استفاده میشود.
در برخی از تکنیکهای بندینگ، الگوهایی ایجاد میشود که شدت رنگگیری آنها، متضاد با الگوهای ایجاد شده با روش G-bands است، این روشها، روشهای معکوس R-bands نامیده میشوند.
(1) دسته اول باندهایی را ایجاد میکنند که در طول یک کروموزوم کامل وسالم، انتشار یافتهاند و شامل تکنیکهایی میباشند که الگوهای همانندسازی DNA را نشان میدهند که از جمله آنها میتوان R-bands ، Q-bandsوG-bands را نام برد.
(2) دسته دوم اجزا ساختمانی خاصی از کروموزومها را رنگآمیزی میکنند و لذا منجر به ایجاد تعداد محدودی از باندها میشوند. این روشها شامل روشهایی میباشند که هتروکروماتین اجباری (C-bands)، باندهای تلومریک (T-bands) و نواحی ساماندهی نوکلئولوس(NORs) را آشکار میسازند.
روش رنگآمیزی با گیمسا معمولترین آنهاست. در این روش کروموزومها ابتدا با تریپسین تیمار میشوند تا محتوای پروتئینی آنها دناتوره شود . هر باند در این روش تقریبا حاوی ۵ الی ١۰ میلیون باز است و ممکن است در برگیرندهی صدها ژن باشد. رنگ گیمسا از ائوزین آنیونی و تیازین کاتیونی (1:2) تشکیل شده است. رسوب رنگ در کروموزومها در مناطقی تشکیل میشود که فسفاتهایDNA در فاصلهی صحیح از هم قرار گرفته باشند، تا دو مولکول تیازین را به هم متصل کنند و سپس به مولکول ائوزین متصل میشوند. به طور کلی باندهای مثبت گیمسا (نواحی تیره) که غنی از AT هستند، کمتر رونویسی شده، تراکم بیشتر و ژنهای اندکی دارند. این مناطق آبگریز هستند. پروتئینهای آبگریز نواحی متراکم را حفظ میکنند و رسوب ترکیب تیازین–ائوزین را تسهیل میکنند. باندهای منفی گیمسا (نواحی روشن) که غنی از GC هستند، بیشتر رونویسی میشوند، تراکم کمتر و ژنهای بیشتری دارند. این مناطق آبگریزی کمتری داشته و در نتیجه کمتر برای رسوب تیازین-ائوزین مناسبند. درجهی وضوح به وسیلهی تعداد باندهای مشاهده شده در یک مجموعهی هاپلویید معین میگردد.
مرحلهی بعدی مهمترین مرحله و قسمت تشخیصی آزمایش کاریوتایپ است که شامل انتخاب گسترهی متافازی، شمارش تعداد کروموزومها و سپس آنالیز دقیق الگوی نواربندی کروموزومها است.
برای اکثر لوسمیها، به جز برخی موارد که از خون محیطی استفاده میشود، از نمونه مغز استخوان استفاده میکنند. سلولهای مغزاستخوان با رشد سریع، باید در معرض مواد غذائی بیشتری قرار بگیرند.
کشت مغز استخوان به دو صورت کشت معمولی و کشت قدرت تفکیک بالا صورت میپذیرد.کشت معمول خود به سه صورت زیر انجام میپذیرد.
کشت مستقیم (direct): به لولهی حاوی محیط کشت کامل و نمونه کلسمید اضافه شده و بعد از 30-60 دقیقه هاروست می شود.
کشت کوتاه مدت (24-48-72 ساعته): بعد از مدت زمان مورد نظر به لولهها کلسمید اضافه و بعد از 30 دقیقه هاروست میشود.
کشت کلسمید در طول شب(ONC): حدود 20 میکرولیتر کلسمید در ساعت 5 یا 6 عصر به لولهی حاوی محیط کشت و نمونه اضافه میشود و صبح روز بعد هاروست میگردد.
برای به دست آوردن کروموزومهای بلندتر باید سیکل سلولی را در مرحلهی S بوسیلهی یک مهار کننده مانند تیمیدین متوقف کرد.بعد از حدود 15 ساعتمهار کننده از طریق شستشو خارج شده و سپس بعد از حدور 4 الی هفت ساعت کلسمسد اضافه میشود و بعد از گذشت حدود 20 دقیقه هاروست انجام میگردد.
انتخاب نوع کشت بر اساس علت مراجعه صورت میپذیرد.
مایع آمنیوتیک در هفته 17 -15 حاملگی، توسط پزشک متخصص زنان به میزان 15-20 سیسی گرفته و در دو لوله پلاستیکی استریل قابل سانتریفوژ تقسیم میشود. نمونهها به سرعت و در دمای مناسب به آزمایشگاه منتقل میشود. مایع آمنیوتیک به رنگ زرد کمرنگ میباشد و اغلب در مراحل بعدی حاملگی وقتی غلظت سلولها بالاتر است، رنگ مایع کدر میشود. ابتدا لولههای حاوی نمونه سانتریفوژ شده و محلول رویی برای آنالیز تستهای شیمیایی فریزمیشود. رسوب باقی مانده را با تکان آرام دوباره به حالت محلول در اورده وسه سیسی محیط مناسب برای هر کشت اضافه میشود .بهتر از محیط کشتهای مختلف برای هر کشت استفاده کرد. دو فلاسک کشت داده میشود. کشتها به مدت 7-6 روز انکوبه میشوند. سپس رشد سلولها با استفاده از یک میکروسکوپ invert بررسی میگردد. در صورت مشاهدهی کلونی محیط برداشته شده و با محیط تازه تعویض میگردد.هر دو روز یکبار نمونهها با میکروسکوپ بررسی وو محیط آن تعویض میشود.بعد از رشد کلونی به اندازهی کافی، می توان یکی از لولهها را هاروست و لولهی دیگر را subculture کرد.به این صورت که محیط در لولهی جداگانهای ریخته میشود سپس به نمونه یک سیسی ازمحلول حاوی EDTAو تریپسین اضافه میشود.در این مرحله برای جدا شدن سلولها ضربه زده شود.سپس دو بار باPBS شستشو انجام شده و مجددا محلول trypsin-EDTA اضافه شده و بعد از ضربه محیط کشت اضافه میگردد. با جدا شدن سلولها از سطح ظرف کشت،برای خنثی کردن اثر تریپسین یک سیسی محیط کامل حاوی سرم اضافه میشود در این مرحله با توجه به مقدار نمونه، درون ظرفهای دیگر آن را aliquot کرده و 3 سیسی محیط تازه اضافه میشود و انکوبه میگردد.
جهت هاروست به ازای هر سیسی نمونه حدود 75میکرولیتر کلسمید اضافه میگردد وپس از حدود سه ساعت انکوبه کردن مرحلهی تریپسینه کردن انجام می شود و سوسپانسیون به دست امده15 دقیقه با دور 1000rpm سانتریفوژ و سپس هاروست میشود.
فانکونی: فانکونی نوعی کمخونی است که با علائم بالینی متنوعی همراه میباشد. نحوهی توراث این بیماری اتوزومال مغلوب است. سلولهای بیماران FA نسبت به عوامل پیوند متقابلDNP، مانند مایتومایسینC (MMC) و دی اپوکسی بوتان (DEB) یا سیس پلاتین، حساس هستند و در مواجهه با دارو به صورت مهار بیش از حد، توقف چرخهی سلولی و شکستگی کروموزومی، آشکار میشوند.
در این آزمایش، لنفوسیتهای Tموجود در نمونه در حضور مایتومایسین کشت داده میشوند. بهتر است برای هر بیمار، از یک کنترل منفی، ترجیحاً همسن و جنس مشابه استفاده شود. چهار کشت برای بیمار و کنترل منفی انجام میشود. یک کشت HR بدون مایتومایسین و سه کشت با غلظتهای متفاوت از مایتومایسین گذاشته میشود. سپس نمونهها هاروست و رنگآمیزی میشوند. پس از آن شکستها و ناهنجاریها در زیر میکروسکوپ بررسی میگردد. اگر تعداد شکستهای کروموزومی نسبت به نمونهی کنترل ۱/۰ بیشتر باشد تشخیص کمخونی فانکونی مثبت است.

سندرم ایکس شکننده یا مارتین بل، که بیشتر به عنوان یک بیماری تکژنی شناخته میشود، یک بیماری ارثی است که از والدین به فرزندان منتقل میشود. این بیماری یکی از شایعترین علل عقبماندگیهای ذهنی میباشد. این بیماری در پسران بیشتر مشاهده شده و علائم شدیدتری دارد.
این بیماری به این دلیل سندرم ایکس شکننده نامیده میشود، که در گسترهی کروموزومی این بیماران در انتهای بازوی بلند کروموزوم ایکس یک مکان شکننده دیده میشود. تقریبا در تمام موارد این بیماری جهش در بالادست ژن FMR1 و به دنبال آن بسط تکرارهای سه نوکلئوتیدی CGG در درون این ژن و متیلاسیون غیرطبیعی آن رخ میدهد. دفعات این تکرار در افراد ممکن است متفاوت باشد. در افراد طبیعی تعداد این تکرارها ده تا پنجاه بار است در حالیکه در افراد مبتلا تعداد این تکرارها ممکن است به بیش از دویست بار برسد. افزایش غیرطبیعی این تکرارها منجر به خاموشی ژن FMR1 شده و در نتیجه پروتئین FMRP تولید نمیگردد. شدت اختلال با تعداد این تکرارها نسبت مستقیم دارد.
یک سوم از بیماران مبتلا به سندرم ایکس شکننده ویژگیهای بیماری اتیسم را نیز نشان میدهند.
برای بررسی سندروم X شکننده سه نوع کشت صورت میگیرد: برای انجام این آزمایش سه کشت انجام میشود. کشت اول بصورتHR (72 ساعته)، کشت دوم با محیط کشت Low folate همراه با سرم گاوی، و کشت سوم به همراه تایمیدین اضافه (92 ساعته). ادامه مراحل آزمایش همانند بالا انجام و در نهایت لامهای آماده شده در زیر میکروسکوپ بررسی و مطالعه میشوند.
PGT ( Preimplantation Genetic Testing) یا تشخیص ژنتیکی قبل از لانهگزینی، روشی است برای شناسایی شرایط ژنتیکی جنینهای حاصل از IVF (لقاح آزمایشگاهی) قبل از آن که به رحم انتقال داده شوند. هدف PGT افزایش احتمال انتقال جنینهای سالم و فاقد بیماریهای ژنتیکی است. این تست بنام PGD نیز شناخته می شود.
در حال حاضر PGT به سه نوع تقسیم می شود:
در این نوع PGT جنینها از نظر ناهنجاریهای کروموزومی خاص مورد غربالگری قرار میگیرند. جنین انسان در هر سلول دارای 23 جفت کروموزوم یا 46 عدد میباشد که نصف آن را از تخمک و نصف آن را از اسپرم دریافت کردهاست. در بعضی مواقع جنینها دارای ناهنجاریهای کروموزومی تصادفی، مانند از دست دادن یا اضافه شدن یک کروموزوم هستند که به آن آنیوپلوئیدی گفته میشود. در اغلب مواقع این ناهنجاریهای کروموزومی تصادفی بوده و از والدین به ارث نمیرسند. انتقال این دسته از جنینها اغلب به سقط جنین یا انتقال ناموفق منجر میشود. برخی از انواع آنیوپلوئیدی ممکن است به تولد نوزادی با شرایط خاص مانند سندرم داون یا سندرم ترنرمنجر شود که مشکلاتی برای خانواده و جامعه را در پی دارند.
اختلال مونوژنیک نوعی اختلال ژنتیکی است که ناشی از تغییر یا تغییرات در ژنی خاص هستند. PGT-M معمولاً زمانی استفاده میشود که سابقه بیماری در خانواده وجود داشته باشد. با داشتن سابقهی قبلی بیماری در خانواده، انجام تستهای غربالگری پیش از بارداری یا پیش از تولد و یا آزمایشهای ژنتیکی قبلی، بیمار کاندید انجام PGT-M میگردد. PGT-M یک روش جایگزین برای PND یا تشخیص پیش از تولد میباشد. آماده شدن برای انجام PGT-M معمولاً به چندین ماه زمان نیاز دارد. انجام PGT-M قبل از انتقال جنین تا حد زیادی احتمال داشتن فرزندی با بیماری خاص را کاهش میدهد.
این نوع PGT زمانی استفاده میشود که یکی از زوجین یا هردو، دارای ناهنجاریهایی مانند جابجایی یا وارونگی باشند. فردی که دارای چنین نواقصی در ساختار کروموزومهاست، در معرض خطر بیشتری برای تولید جنینهای دارای حذف و اضافه شدن کروموزومها هستند. این شرایط در اغلب مواقع منجر به سقط جنین، مردهزایی و یا تولد نوزادی با مشکلات جدی میگردد.
بیوپسی جنین: نمونه برداری از جنین یا بیوپسی جنین در مراحل مختلف تکوین جنین قابل انجام است که همگی آنها تهاجمی محسوب میشوند.
بیوپسی اجسام قطبی: بیوپسی از اجسام قطبی اول و دوم در حال حاضر توسط مراکز محدودی انجام میشود. مزیت این روش این است که حذف اجسام قطبی اثر مخربی بر جنین ندارد. مهمترین محدودیت این روش محدود بودن تشخیص به صفات ژنتیکی مادر است و ژنوتیپ به ارث رسیده از پدر در این روش قابل بررسی نیست.
بیوپسی در مرحله Cleavage : بیوپسی در این مرحله (جنین تفریباً سه روزه) سالها بعنوان استاندارد طلایی محسوب میشده است. مهمترین اشکال این روش محدود بودن میزان DNA جنینی برای بررسی آزمایشگاهی میباشد. در این روش زمان کافی برای بررسی جنین در اختیار متخصصین ژنتیک قرار دارد(انتقال روز پنجم).
بیوپسی تروفواکتودرم: بیوپسی بلاستوسیست یا تروفواکتودرم در حال حاضر پرکاربرد ترین روش میباشد. بیوپسی تروفواکتودرم برای آنالیز ژنتیکی جنین سلولهای بیشتری را فراهم میکند (5-10 سلول) و آزمایشات با دقت بیشتری انجام میشوند. مهمترین مشکل در این روش زمان محدود برای ارزیابی ژنتیکی جنین است و با فریز جنینها و انتقال آنها در سیکلهای بعدی، میتوان این مشکل را برطرف نمود.
بیوپسی غیر تهاجمی یا کم تهاجمی: در این روش از DNA آزاد جنینی که در مایعات بلاستوسیست یا محیط کشت مصرف شده وجود دارند استفاده میشود. این روش برای جنینشناس زحمت کمتری دارد و جنین نیز متحمل آسیب بسیار کمتری میشود. مهمترین چالشهای این روش، دقت و حساسیت پایینتر و آلودگی با DNA مادر است. اما بههرحال بعنوان یک روش جایگزین قابل استفادهاست.
PGD از یک طرف زوجین را قادر میسازد که فرزندان سالمی داشته باشند و از طرف دیگر از بروز مشکلات سلامتی ، روانی و مالی ناشی از ختم بارداری پیشگیری میشود. PGD اولین بار توسط Handyside و همکارانش با استفاده از روش PCR برای جلوگیری از انتقال یک صفت وابسته به جنس انجام شد. از آن زمان تاکنون از این تکنیک برای بیماریهای مختلف انجام شده است. در ایران PGT-M برای بیش از 600 ژن مختلف توسط متخصصین نما ژن (در مراکز مختلف) انجام شدهاست و صدها فرزند سالم در آغوش خانوادهها قرار گرفتهاند. اندیکاسیونهای مهم PGD را میتوان به شرح زیر خلاصه کرد.
دو تکنیک FISH و PCR مهمترین روشهایی هستند که تاکنون برای انجام PGD مورد استفاده قرار گرفته شدهاند. در تکنیک PCR از مقادیر کم DNA جنین میلیاردها کپی تکثیر و امکان آنالیز آن میسر میشود. تکنیک FISH این امکان را فراهم میکند که در یک سلول بتوان شمارش کروموزومها را انجام داد. از این تکنیک عمدتاً برای ناهنجاریهای شناخته شده مانند سندرم داون و جابجائیهای کروموزومی استفاده میشود. در سالهای اخیر از تکنیکهای دیگری نیز مانند aCGH و NGS و… نیز برای آنالیز ژنتیکی جنینها استفاده شدهاست. هر کدام از این روشها کاربردها، مزایا و معایب خاص خود را دار میباشند.
روش انجام PGD مشابه روش IVF یا لقاح آزمایشگاهی است و در مراحل پایانی قبل از انتقال جنینها به رحم مادر، جنینها مورد ارزیابی ژنتیکی قرار میگیرند تا از انتقال جنینهای مبتلا اجتناب شود. خلاصهای از مراحل PGD در زیر بیان شدهاند.
مرحله 1- تحریک تخمدانها: در این مرحله با استفاده از هورمونها ، تخمدانها را وادار به تولید تعداد زیادتری تخمک میکنند. با توجه به ابتلای تعدادی از جنین ها با افزایش تعداد تخمک و جنین احتمال داشتن جنینهای سالم و موفقیتآمیز بودن سیکل بالا میرود.
مرحله 2- جمع آوری تخمک: در زمان مناسب تخمکها از تخمدانها برداشت شده و مورد ارزیابیهای خاص قرار میگیرند.
مرحله 3- تزریق اسپرم: برای PGD بویژه زمانی که هدف بررسی بیماریهای تک ژنی باشد (PGT-M) بهتر است از روش ICSI استفاده شود. در این روش یک اسپرم منفرد به داخل تخمک تزریق میشود.
مرحله4- لقاح: یک روز بعد از تزریق یا تلقیح اسپرم، جنینشناس تخمکها را بررسی کرده تا وضعیت لقاح هر تخمک مشخص شود.
مرحله 5- بیوپسی جنین: تخمکهایی که بارور شدهاند در روزهای سوم تا پنجم مورد بیوپسی قرار میگیرند و یک یا چند سلول برداشت شده و برای آزمایشات ژنتیک ارسال میشوند. برداشتن این سلولها نباید به جنین آسیبی وارد کند.
مرحله 6- آزمایش جنین: سلولهای جداشده برای ناهنجاری ژنتیکی مربوطه مورد آزمایش قرار میگیرند.
مرحله 7- انتقال جنین: در این مرحله یک یا دو جنین سالم به رحم مادر انتقال داده میشوند. سایر جنینهای سالم را میتوان فریز نمود و در سیکلهای بعدی انتقال داد. جنینهای مبتلا با رضایت والدین یا برای آموزش و پژوهش استفاده میشوند یا از بین برده میشوند.
مرحله 8- تست بارداری: تقریباً دو هفته بعد از انتقال جنین تست بارداری انجام میشود و موفقیتآمیز بودن سیکل انتقال مشخص میگردد. در مواردی که انجام PND مقدور میباشد بهتر است آزمایشات PND نیز انجام شود.
در سالهای اخیر استفاده از PGD کاربردهای گستردهتری پیدا کردهاست که برخی از این موارد با مسائل اخلاقی، حقوقی و اجتماعی خاص خود مورد توجه پژوهشگران این حوزه قرار گرفتهاند. از جمله این موارد میتوان انجام PGD به منظور تعیین جنسیت، بیماریهایی که در سنین بالاتر رخ میدهند مانند انواع سرطانها و هانتینگتون، انجام HLA جهت نجات جان کودک بیمار و … را نام برد. از دیگر موارد چالش برانگیز در عرصههای حقوقی و اجتماعی مرتبط با PGD میتوان آسیبهای احتمالی مادر و جنین، حذف تعدادی از جنینها، هزینههای تحمیل شده بر خانواده و … را نام برد.
مانند اغلب روشهای مورد استفاده در پزشکی استفاده از PGT نیز محدودیتهایی دارد که بیماران باید به آن توجه کنند. اگرچه دقت این تست بسیار بالاست اما صد در صد نیست و موارد مثبت و منفی کاذب نیز ممکن است رخ دهند. علاوه بر این تعداد محدودی از نقایص ژنتیکی در این تکنیکها ممکن است قابل شناسایی نباشند.
تشخیصهای مولکولی در سالهای اخیر وارد حوزههای درمانی شدهاند و با تغییر در نگرش و بینش متخصصان در مورد بیماریها، باعث ایجاد تحول در مراقبتهای بهداشتی گردیدهاند. درآزمایشگاههای تشخیصی مولکولی، مواد ژنتیکی یا پروتئینهای مرتبط با یک بیماری یا یک شرایط خاص مورد شناسایی و ارزیابی کمی و کیفی قرار گرفته میشوند. در این شرایط درک مکانیسمهای اساسی بیماریها، تسهیل شده و برای پزشکان برای درمانهای کارآمدتر راهگشا خواهد بود. پیشرفت مستمر در تکنولوژی، سرعت و عملکرد تشخیص مولکولی را افزایش داده و امروزه تعیین توالی کل ژنوم تقریباً برای همگان در دسترس میباشد. قابلیت انجام تستهای مولکولی بصورت اتوماتیک این امکان را فراهم آورده که این نوع از تستها برای کل مناطق جهان در دسترس باشند. تشخیص مولکولی بخش گسترده از تستهای تشخیصی را در برمی گیرد که به معنای واقعی کلمه سلامت فرد در سطح مولکولی ارزیابی میشود. در این تکنیکها توالیهای خاصی در DNA، RNA و پروتئینها شناسایی و اندازه گیری میشوند. این تکنیکها همچنین میتوانند حضور ویروسها ، باکتریها و سایر سلولهای خاص را شناسایی و اندازه گیری نمایند.
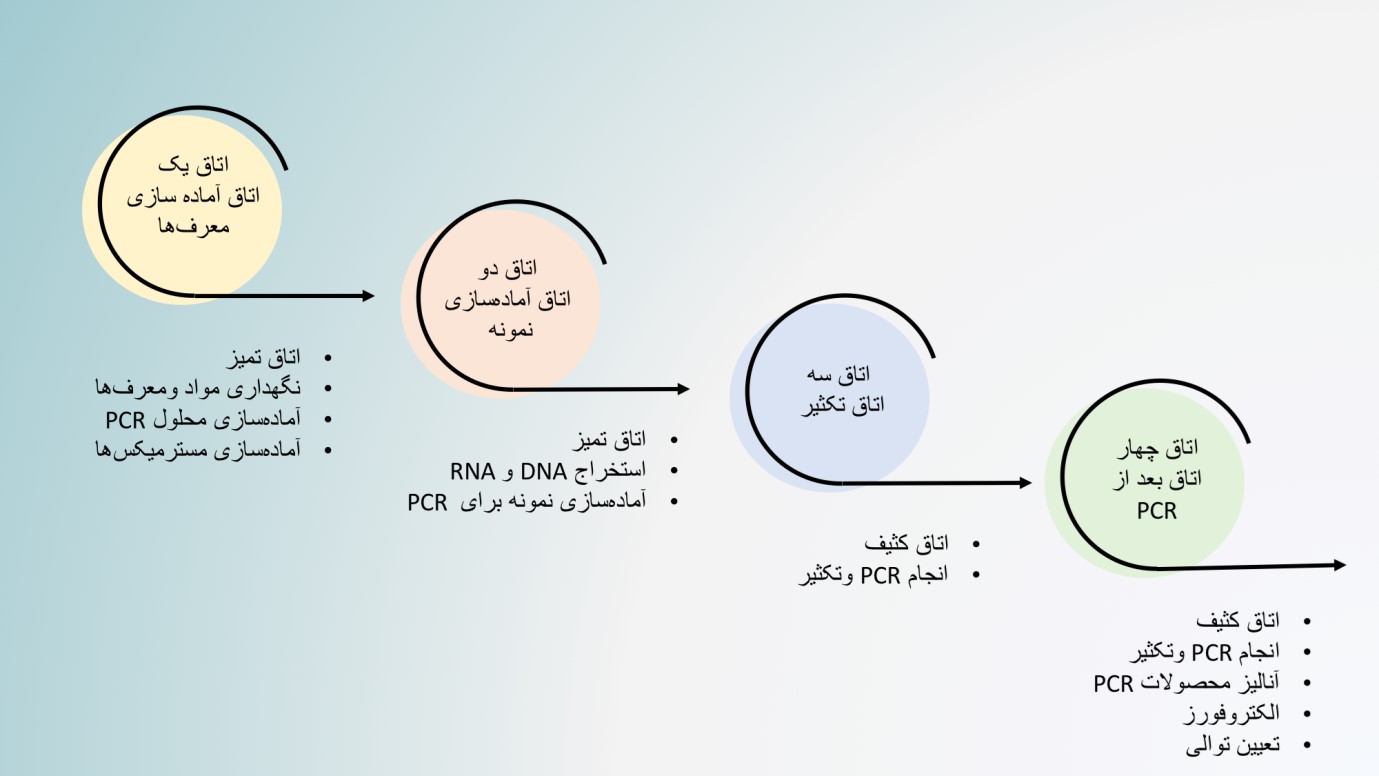
تاسیس آزمایشگاه مولکولی به فضای کافی، تجهیزات فنی مناسب و نیرو انسانی واجد شرایط نیاز دارد. الزامات تاسیس یک آزمایشگاه استاندارد با توجه به نوع فعالیت آزمایشگاه میتواند متفاوت باشد ولی چندین معیار اساسی وجود دارد که بهتر است رعایت شوند. یکی از مهمترین نکاتی که در طراحی آزمایشگاه مولکولی باید مورد توجه قرار گیرد، شرایط فیزیکی آزمایشگاه است. روشهای مبتنی بر PCR به آلودگی بسیار حساس هستند و هدف اصلی در طراحی فضاهای آزمایشگاه مولکولی جلوگیری از ایجاد آلودگی است. به دستآوردن مقدار زیادی محصول PCR از یک الگوی بسیار کم یک مزیت ویژه برای PCR محسوب میشود اما همین ویژگی در صورت وجود آلودگی منجر به نتایج نادرست و کاذب میگردد. نتایج مثبت کاذب ممکن است ناشی از انتقال از یک نمونه به نمونه دیگر، آلودگی متقابل از نمونههایی که بطور همزمان آماده میشوند ، محصولات PCR قبلی و آلوده بودن محلولها و مواد مورد استفاده باشد. در روش Real Time PCR معمولاً لولهها بسته میمانند و خطر ایجاد آلودگی کاهش مییابد. با توجه به اینکه تکنیکهای اصلی مورد استفاده در آزمایشگاههای مولکولی مبتنی بر PCR هستند، میتوان آنها را به دو فرآیند اصلی قبل از PCR(آماده سازی نمونه و آماده سازی مخلوط PCR) و بعد از PCR(انجام PCR و آنالیزهای بعد از آن) تقسیمبندی نمود. ضروری است این مراحل در فضاهای جداگانهای تحت عنوان “تمیز” و “کثیف” انجام شوند. ناحیهی تمیز در واقع ناحیهای است که تمام مراحل قبل از PCR مانند پردازش نمونه، استخراج DNA/RNA و آماده سازی PCR در آن انجام میشود. ناحیه کثیف هم فضایی است که در آن محصولات PCR(Amplicons) تولید و مورد ارزیابی قرار گرفته میشوند. کارکنان آزمایشگاه باید تمام معرفها ، مواد و تجهیزات موجود در این فضاها را همیشه جدا از هم نگه دارند و انتقال این اقلام از فضای کثیف به فضای تمیز مجاز نمیباشد. با جداسازی فیزیکی اتاقهای تمیز و کثیف از همدیگر و انجام فعالیتهای قبل و بعد از PCR در فضاهای جداگانه آلودگی به میزان قابل توجهی کاهش مییابد. بنابراین در هنگام طراحی آزمایشگاه مولکولی ، حداقل دو فضای مجزا باید در نظر گرفته شود. اتاقهای تمیز و کثیف به ترتیب Pre-PCR و Post-PCR گفته میشوند. با این حال در صورت وجود فضای کافی، برای ایجاد یک آزمایشگاه مولکولی ایدهآل بهتر است چهار اتاق مجزا برای آمادهسازی معرفها، آمادهسازی نمونه، مرحله PCR و مراحل پس از PCR در نظر گرفته شود. هر اتاق باید تجهیزات لباس و مواد مصرفی خود را داشته باشد و نباید مواد و تجهیزات بین اتاقها جابهجا شود.
گردش کار در آزمایشگاههای مولکولی باید یکطرفه و از سمت تمیز به سمت کثیف باشد و هیچ ماده ای ازسمت کثیف نباید به سمت تمیز آورده شود. در صورتی که همه مراحل به ناچار باید در یک اتاق انجام شود، برای هر کاری باید هودها و فضاهای جداگانه در نظر گرفت و مراحل قبل و بعد از PCR را در ساعتهای مختلف روز انجام داد. بعد از انجام هرکاری باید از نور UV برای استریل کردن فضاها استفاده شود.
طراحی و گردش کار در یک آزمایشگاه مولکولی بصورت زیر می باشد.
فشار هوا در هر آزمایشگاه باید جداگانه تنظیم شود و هر فضایی باید تهویه مخصوص خود را داشته باشد. گردش هوا بین آزمایشگاههای قبل و بعد از PCR یکی از مهمترین منابع آلودگی در آزمایشگاههای مولکولی است. در فشار هوای مثبت، فشار هوای داخل اتاق بیشتر از فشار هوای بیرون اتاق است و از ورود مواد ناخواسته به داخل اتاق جلوگیری میشود. در اتاق قبل از PCR فشار هوا باید مثبت باشد تا از ورود هوای آلوده به داخل اتاق جلوگیری شود . از طرف دیگر فشار اتاق بعد از PCR باید منفی باشد تا هوا را در داخل خود نگه دارد و از خروج امپلیکونها جلوگیری شود. درها باید بسته نگه داشته شوند تا فشار مثبت و منفی اتاقها حفظ شود. اتاقهای قبل و بعد از PCR باید کانال تهویه جداگانه داشته باشند و در جهتهای مختلفی باز شوند.
اشعه UV باعث آسیب DNA میشود و برای از بین بردن آلودگیهای DNA میتواند مفید باشد. DNA درحالت خشک در برابر UV مقاومتر از DNA محلول در آب میباشد و بنابراین استفاده از UV برای حذف آلودگی از سطوح خشک آزمایشگاهی اثر کمتری دارد. منبع نور UV را میتوان روی سقف یا روی میز آزمایشگاه قرار داد و اُزن تولید شده ناشی از تابش اشعه ماوراء بنفش باید تهویه گردد. در نتیجه اکسیداسیون، رسوباتی روی شیشه لامپ جمع میشود که اثربخشی UV را کاهش میدهد و این رسوبات ماهانه باید حذف شوند.
تستهای مولکولی در اغلب موارد کاملاً حساس و اختصاصی هستند و نتایج بسیار دقیقی را در پی خواهند داشت. مکانیسمهای کنترلی متعددی مانند تایید توالی پرایمر و پروب، بهینه بودن شرایط انجام آزمایش و استفاده از کنترلهای منفی برای کاهش نتایج مثبت کاذب باید اعمال شود. روشهای تشخیصی فعلی بسیار حساس بوده و امکان تشخیص و تکثیر یک مولکول DNA را دارند. بنابراین امکان تکثیر و تشخیص آلودگیهای DNA را باید مد نظر قرار داد و استراتژی پیشگیری از آلودگی باید در اولویت آزمایشگاههای مولکولی قرار گیرد.
آلودگی متقاطع (Cross-Contamination) یکی از منابع خطا و آلودگی در آزمایشگاههای مولکولی است و ممکن است در هر مرحله از فرآیند پردازش نمونه یا در حین استخراج DNA رخ دهد و در نتیجه باعث نتایج مثبت یا منفی کاذب میشود. میکروارگانیسمها (ویروسها، باکتریها و..) نیز ممکن است در طی این فرآیندها از یک مورد به مورد دیگر منتقل شوند.
DNA تکثیر شده از واکنشهای قبلی، کنترلهای مثبت مورد استفاده در آزمایشات، نمونههای حاوی پلاسمید، لباسها، زبالههای آزمایشگاهی و سطوح تمیز نشده، از منابع بالقوه آلودگی در آزمایشگاههای مولکولی هستند. به منظور پیشگیری از آلودگی و کنترل آن، شرایط فیزیکی مناسب، طراحی فضاها، بکارگیری دقیق تکنیکهای آزمایشگاهی، پروتکلهای کنترل محیطی و برنامه گردش کار ضروری است و فقط پرسنل مسئول و آموزش دیده باید در محیط آزمایشگاه حضور داشته باشند.
مدیریت کیفیت در تمام مراحل ارزیابی آزمایشگاه تشخیص مولکولی ضروری است و یک جزء مهم در انجام آزمایشات مولکولی محسوب میشود.
در صورتی که قصد راهاندازی آزمایشگاه مولکولی ژنتیک و تشخیص بیماریهای عفونی را دارید با کارشناسان شرکت نماژنآزما تماس بگیرید.
فنآوریهای تشخیصی به سرعت در حال پیشرفت هستند و باید پذیرفت که در مراحل اولیه درک استفاده از مفاهیم پیچیده ژنومیکس و پروتئومیکس هستیم و بسیاری از وعدههای تشخیص مولکولی هنوز محقق نشدهاند. شناسایی نشانگرهای مولکولی در جمعیتهای مختلف ، شناسایی سریع پاتوژنها، مولتیپلکس کردن آزمایشات، توالی یابی ژنتیکی، ادغام روشهای ژنتیکی با فنآوری IT و روشهای تحلیل دادهها از چالشهای پیشرو است. انتظار میرود تلفیق فنآوریهای جدید مانند نانو با تکنینکهای تشخیصی فعلی، کارایی بیشتری را در پی داشته باشد. این فنآوری میتواند علاوه بر افزایش حساسیت و اختصاصیت تستهای تشخیصی امکان مولتیپلکس کردن را نیز فراهم کند. توالییابی مبتنی بر نانو از دیگر رویکردهایی است که مورد توجه پژوهشگران قرار دارد. در نهایت پیشرفتها به سمتی باید بروند که این دسته از تستهای تشخیصی در آزمایشگاههای کمتر تخصص یافته نیز به آسانی قابل انجام باشند و زمان انجام آزمایشات نیز کاهش یابد.
021-28423622
021-28423622
پاسداران، نبش بهستان هفتم، پلاک 2، طبقه اول
info@namagene.com

شرکت نماژن آزما مفتخر است تا به عنوان یک شرکت دانشبنیان با اتکا به دانش بینالمللی و کارشناسان خبره در مسیر پیشرفت و بومیسازی فناوریهای علوم زیستی قدم برداشته است.